Корни наших зубов находятся в костной ткани челюсти. Благодаря тому, что во время пережевывания пищи кость получает нагрузку от зубов, она полноценно функционирует, насыщается питательными веществами. Но как только зуб удаляется, на его месте образуется пустое пространство – клетки кости растут достаточно медленно и не успевают заполнить это место. В результате кость уменьшается в размерах, к тому же обменные процессы нарушаются и клетки перестают получать кислород и питательные вещества. Кость атрофируется.
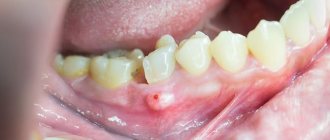
Атрофия костной ткани является большой проблемой при отсутствии большого количества зубов. Ведь в этом случае возникают не только эстетические и психологические проблемы (кожа лица обвисает, появляются морщины возле губ, щеки проваливаются, губы становятся более тонкими и западают внутрь полости рта), но и функциональные – ведь питаться при отсутствии зубов вряд ли получится полноценно и качественно.
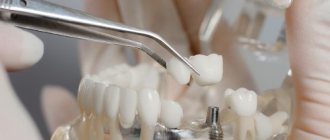
Направленная регенерация костной ткани – это хирургическая операция, цель которой – восстановить объем челюстной кости, то есть нарастить ее до прежних размеров, заложенных природой. Данная операция в основном проводится как подготовительный этап перед имплантацией зубов – ведь для того, чтобы вживить и надежно закрепить имплантаты (искусственные металлические корни) требуется достаточный объем прочной кости. Иногда она может проводиться вместе с установкой имплантатов.
Специальные предложения!
Пластика костной ткани, открытый синус-лифтинг — 35 000 руб. Закрытый синус-лифтинг (область 1 зуба, без учета стоимости костного заменителя) — 10 000 руб. Направленная регенерация костной ткани (область 1 зуб) — 10 000 руб. Направленная регенерация костной ткани (НРК) — 35 000 руб.
Материалы для наращивания костной ткани
Само слово «регенерация» в переводе с латинского означает «возрождение» или «возобновление». Операция проводится хирургическим путем и суть ее сводится к подсадке костного материала в область, где объема челюстной кости недостаточно.
Для регенерации костной ткани могут применяться различные материалы:
- собственная кость пациента: самый предпочтительный вариант, поскольку в этом случае достигается 100% результат приживления материала. Кусочек кости заимствуется, как правило, из области подбородка, угла нижней челюсти (где расположены самые дальние зубы мудрости) или тазобедренной области. Явный недостаток в том, что часто приходится проводить два хирургических вмешательства одновременно,
- искусственные синтетические материалы: разработаны в лабораторных условиях. Довольно распространенный вариант, сегодня используется повсеместно, в большинстве случаев в качестве дополнительного материала при подсадке собственной кости пациента. Отличается хорошей приживаемостью,
- родственная кость: как правило, это очищенная трупная кость другого человека, которая находится в стерильной банке. Также хорошо приживается, при этом не требуется дополнительное хирургическое вмешательство,
- кость животного: материал может быть представлен в виде костных блоков или в виде стружки. Хорошо приживается и почти не отторгается.
Регенерация кости: как проводится?
Операция длится 1-2 часа, в зависимости от объема и сложности работ. Через 3-4 месяца, когда подсаженный кусочек срастется с натуральной костью, можно будет переходить к установке имплантатов. В некоторых случаях может потребоваться больше времени на приживление, в зависимости от индивидуальных особенностей организма. Технология проведения регенерации костной ткани следующая:
- вводится анестезия, в некоторых случаях, если требуется серьезное хирургическое вмешательство возможно проведение операции под наркозом,
- создается доступ к кости: надрезается и отслаивается кусочек десны, при помощи защитных мембран, которые со временем самостоятельно рассасываются, формируется полость для заполнения костной стружкой,
- вводится костный материал: полость заполняется искусственным или натуральным костным материалом. Через 2-4 месяца клетки натуральной кости проникнут вглубь подсаженного материала, и он превратиться в собственную костную ткань – тогда можно будет приступать к имплантации. Сверху новая кость прикрывается защитной мембраной, которая будет защищать от давления со стороны десны,
- десна ушивается – на слизистой фиксируются швы, которые снимаются в среднем через неделю.
Мнение специалиста
Эмир Романович Омерэлли
Челюстно-лицевой хирург, имплантолог
Стаж: более 13 лет
Если по результатам обследования врач диагностирует недостаток костной ткани, необходимо обязательно нарастить ее объем перед проведением имплантации. Установка имплантов в низкую или узкую кость сопряжена с серьезными рисками. Кость может расколоться, или сам имплант выпадет после непродолжительного использования. Чтобы этого не случилось перед классической имплантацией верхних зубов необходимо провести синус-лифтинг, для нижних – наращивание посредством остеопластики. Исключением является только базальный протокол, согласно которому импланты можно устанавливать без костной пластики и без рисков.
Если костной ткани не хватает по ширине, то есть она очень тонкая, операция может проводиться путем расщепления альвеолярного гребня: сначала отслаивается десна, затем кость по длине разрезается и внутрь помещается искусственный или натуральный костный материал.
Также проблема узкой костной ткани решается подсадкой костного блока, позаимствованного из другой кости самого пациента. Для этого кусочек кости помещается под десну, фиксируется на специальные винты, вокруг посыпается костной стружкой, прикрывается барьерной мембраной и десной – слизистая ушивается. Такой вариант более предпочтительный, поскольку собственная кость в большинстве случаев приживается.
Операция по наращиванию костной ткани в зависимости от показаний может проводиться одновременно с установкой классических имплантатов без их последующей нагрузки. То есть искусственные корни фиксируются в кости, но прикрываются десной – протезы будут зафиксированы через 3-4 месяца. Для того, чтобы классические имплантаты прижились в кости необходимо обеспечить их покой и избавить от любого давления.
Осложнения после регенерации костной ткани
Операция наращивания костной ткани считается одной из самых безопасных в стоматологии, сложных, но при грамотном проведении – без каких-либо неприятных последствий. В первые дни после операции уже становится ясно – приживается блок или операцию придется провести заново. Из неприятных ощущений – небольшие отеки тканей и боли в области забора костного блока и места его пересадки. Но через 2-4 дня все неприятные ощущения проходят самостоятельно.
После наращивания костной ткани
После процедуры регенерации кости пациенту необходимо соблюдать меры предосторожности: обязательно пить лекарственные препараты, назначенные врачом – для быстрого восстановления организма, не игнорировать обезболивающие средства. В течение 2-3 часов после операции стоит отказаться от приема пищи, после она должна быть теплой, но не слишком холодной или горячей. Пережевывать продукты рекомендуется на противоположной от хирургического вмешательства стороне. Кроме того, на время необходимо отказаться от физических нагрузок и пару дней после операции обеспечить организму покой. Не забудьте посетить своего лечащего врача для профилактического осмотра и контроля результатов лечения.
Другие работы
Источники регенерации
Восстановление целостности кости происходит путем пролиферации клеток остеогенного слоя надкостницы, эндоста, недостаточно дифференцированных плюрипотентных клеток костного мозга, а также вследствие метаплазии гиараосальних тканей.
Современные представления о процессах регенерации костной ткани сочетают концепции неопластической и метапластическая теорий. Преостеогенными клетками считают остеобласты, фибробласты, остеоциты, перициты, гистиоциты, лимфоидные, жировые и эндотелиальные клетки, клетки миелоидного и эритроцитного рядов.
При сращения сломанных костей установлена стадийность репаративного остеогенеза, которая имеет условный характер. Деление на стадии не имеет принципиального значения, поскольку они в динамике перекрываются.
Даже при идеальной репозиции и фиксации отломков дифференцировки различных клеток происходит одновременно, и поэтому стадийность репаративного процесса трудно разграничить. Но для выбора оптимальной тактики лечения больных нужно иметь представление о закономерностях репаративного остеогенеза.
Примеры работ «До» и «После»
Восстановление всех зубов на верхней и нижней челюсти — базальная имплантация
Случай: частичное отсутствие зубов на верхней и нижней челюсти, осложненное тяжелой формой пародонтита (подвижность зубов).
Комплексная одномоментная имплантация нижней челюсти
Случай: на нижней челюсти имелся расшатавшийся мост из 4 передних зубов, после диагностики было назначено удаление оставшихся зубов и косплексная базальная имплантация.
Восстановление всех зубов методом базальной имплантации (март 2012)
Случай: частичная адентия, оголенные корни собственных зубов, пародонтит, повышенная подвижность зубов, сильная атрофия костной ткани в некоторых местах свыше возможных норм для классической имплантации зубов.
Восстановление передних зубов методом базальной имплантации (апрель 2012)
Случай: частичное отсутствие передних зубов и разрушение опорных зубов под протезом, нарушен рельеф десны и межзубных сосочков.
Регенерация костей: основные сведения
Репаративная регенерация — это восстановление поврежденной или потерянной ткани. Степень и качество регенеративного процесса в различных тканей различна. Чем выше дифференцировки ткани (нервная, мышечная), тем меньше у нее способность к восстановлению своей структуры. Поэтому анатомическое восстановление поврежденного участка происходит за счет замещения дефекта соединительной тканью — рубцом. Поврежденая костная ткань способна пройти ряд стадий репаративного процесса и восстановить свою анатомическую форму, гистологическую структуру и функциональную пригодность.
Перелом кости сопровождается повреждением прилежащих мягких тканей и вызывает стрессовую ситуацию, которая сопровождается местной и общей реакциями организма. В процессе восстановления костной ткани происходят сложные общие и местные биологические и биохимические изменения, которые зависят от кровоснабжения кости, возраста больного, общего состояния организма, а также качества лечения.
The effect of low frequency electrical stimulation on bone tissue regeneration
1.Clinic premorbid and emergency conditions FKU “MONKS” them. P. V. Mandryka MO, 121002 Moscow, Silver lane,4. 2.FSBI research Institute of General pathology and pathophysiology, 125315 Moscow, the Baltic St.8. 3.FSBI Institute of biology of development. N. K. Koltsov Academy of Sciences, 119334, Moscow, Vavilov St,26. 4.LLC “Medical center HuanDi”
The study was performed on 30 male rats of Wistar line (weight 330 – 360 g, age 3.5 months). In an experimental model of damage to the femur bone in the hip joint studied the effect of low frequency electrical stimulation of the damaged area on the rate of regeneration of bone. The animals were divided into two groups. Control (15 rats) and experienced (15 rats). In the experimental animals underwent stimulation of the injury site for 5 min daily for 7 days, 14 days and 21 days. Stimulation was carried out using a device “Osteon-1” generating a mixed signal of two voltage pulse of varying duty cycle, one of which is modulated to a higher frequency. Signals were not synchronized with respect to each other, unipolar with varying frequencies and amplitudes. The obtained results show the effectiveness of the electrical stimulation currents of low frequency in the restoration of bone tissue after damage. Morphological studies showed that electrical stimulation to accelerate the regeneration of damaged bone at all stages of the study (7,14,21 day), causes a more pronounced integration of newly formed bone with the old intact bone and promote the formation of more powerful periosteal calluses in comparison with the control.
В большинстве стран мира отмечается значительное снижение смертности, вследствие этого увеличение продолжительности жизни и, соответственно, старение населения [1]. Однако улучшение деятельности здравоохранения еще не означает улучшение качества жизни, как отдельного индивидуума, так и всего общества в целом. [2]. К сожалению, прогресс, достигнутый в увеличении продолжительности жизни, не сопровождается прогрессом в уменьшении инвалидизации пожилых людей.
Следует подчеркнуть, что количество пожилых людей во всем мире стремительно увеличивается. В частности, в Российской Федерации в настоящее время доля пенсионеров по старости составляет 20,6% [3].
Остеопороз входит в число наиболее актуальных проблем современного здравоохранения. В России остеопорозом страдают 14 млн человек старше 50 лет. Еще у 20 млн обнаруживается остеопения [4,5]. Остеопороз занимает четвертое место по частоте инвалидизации после болезней сердечно-сосудистой системы, сахарного диабета и онкологических заболеваний.
Согласно данным ВОЗ, этим заболеванием страдают около 75 млн граждан Европы, США и Японии. В связи с постарением населения Европы к 2050 г. ожидается рост количества остеопоротических переломов шейки бедренной кости с 500 тыс. до 1 млн случаев ежегодно [6. Особенно часто остеопороз встречается у пожилых женщин вследствие снижения уровня половых гормонов. Помимо переломов отмечается также устойчивый рост дегенеративно-дистрофических заболеваний суставов (остеоартроз, остеопороз, асептический некроз). Заболевания суставов сопровождаются хронической болью. Исследования, проведенные в США показали, что у женщин, испытывающих боль, падения случаются в 1,66 раз чаще [7], а это при остеопорозе в большинстве случаев неизбежно приводит к перелому костей.
Общим патогенетическим механизмом этой группы заболеваний является – нарушение структуры костной ткани, сопровождающееся сложным локальным или системным нарушением процессов костного ремоделирования.
Все вышесказанное свидетельствует о том, что проблема лечения нарушений костного ремоделирования является актуальной и в связи с нарастающим старением населения все больше актуализируется.
Накопленный опыт медикаментозного лечения дегенеративно-дистрофических заболеваний показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество костной ткани [8]. Кроме того, следует учитывать и тот факт, что у пожилых и старых людей, как правило, имеется целый ряд коморбидных состояний и, соответственно, отмечается вынужденная полипрагмазия. Поэтому в последние десятилетия проводится интенсивный поиск возможностей применения для стимуляции остеогенеза не фармакологических, а физических методов: переменного электромагнитного поля высокой и низкой частоты, постоянного электрического тока, ультразвука, имеющих ряд преимуществ при их практическом применении [9-11]. Преимуществами этих методов воздействия являются: безопасность, возможность длительного многофакторного воздействия, отсутствие привыкания.
Опыт лечения некроза головки бедренной кости показал, что внешние электрические сигналы могут вызывать клеточную реакцию, приводящую к реконструкции поврежденной кости [12-15].
Учитывая результаты многочисленых экспериментальных и клинических исследований свидетельствующих об эффективном действии электростимуляции на различные системы организма и, в частности, на снижение тугоподвижности суставов, спастичности мышц и подавлении болевого синдрома после переломов, ускорение регенерации кости [9, 16-18] был разработан аппарат «Остеон-1» для эффективного восстановления структуры костной ткани [13].
Цель настоящей работы – гистологическое исследование эффективности восстановления костной ткани при стимуляции поврежденной кости животных с помощью прибора «Остеон-1».
Что такое направленная костная регенерация
Направленная костная регенерация — это операция по возмещению недостатка костной ткани заменителем, который закрепляют барьерной мембраной. После процедуры вокруг трансплантата образуется каркас (его формируют сосуды и клетки-остеоциты, которые продуцируют новую ткань). Натуральная кость постепенно заменяет искусственный материал.
Наращивание методом НРК производят по классическим параметрам:
- толщина вестибулярной костной стенки (у щеки) — до 2-2,5 мм;
- толщина кости между имплантатом и корнем соседней единицы — до 2,5-3 мм;
- толщина костной стенки между двумя титановыми корнями — до 3 мм.
Этапы НРК
Операцию организуют под анестезией. Хирург действует по классическому алгоритму:
- Разрезает десну вдоль лунки потерянного зуба, делает несколько разрезов сбоку — отслаивает десневой лоскут.
- Фиксирует в оголенную кость имплант (если операцию организуют одновременно с имплантацией).
- Замещает недостающий объем трансплантатом, покрывает его мембраной с выступом на 2-3 мм за пределы костного материала. Если не исключает факт вдавливания мембраны внутрь дефекта, сверху накладывает титановую сетку.
- Закрепляет мембрану (швами или винтами).
- Сводит края раны, накладывает швы.
Операция длится 1-1,5 часа.
Виды мембран
Мембранная техника, которую использует хирург, нужна для изоляции пространства от фиброзной ткани — создания условий для нормальной регенерации ткани. К мембранам предъявляют несколько требований:
- биологическая совместимость;
- прочность;
- предупреждение миграции клеток эпителия;
- соответствующий период резорбции.
В практике применяют два типа мембран:
- Резорбируемые.
Самостоятельно рассасываются через 6-24 недель после наращивания. Мембраны применяют при небольших дефектах (когда нужно нарастить не больше 2 мм) — они не так хорошо держат форму, как следующий вид. - Нерезорбируемые.
Не рассасываются — их устраняют через несколько месяцев после операции.
Для быстрого срастания искусственного материала с костной тканью челюсти в ряде случаев используют мембраны из плазмы крови пациента.
Можно ли проводить одновременно с имплантацией
Две операции комбинируют в одну при соблюдении условий:
- форма дефекта позволяет правильно установить искусственный корень в любой из плоскостей;
- при установке имплантат находится в пределах костного контура (не выходит за касательную, проведенную к линии кости);
- устраняют горизонтальный (не вертикальный) дефект.
Вживленный имплант может стать барьером для роста кровеносных сосудов и тормозить формирование новой кости. Если имплантат выступает за контур костной ткани, не исключают риск получения сформировавшейся фиброзной ткани с включениями подсаженного материала.
Методика
Работа выполнена на 30 крысах-самцах линии Wistar (вес 330 – 360 г, возраст 3,5 мес). Крыс содержали в стандартных условиях по 5 особей в клетке с контролируемыми режимами температуры (24 oC) и освещения (в течение 12 ч) и со свободным доступом к воде и пище. Операцию по моделированию травмы проводили под общим наркозом. Сначала животных анестезировали легким эфирным наркозом. Для более глубокого наркоза, использовали хлоралгидрат, внутрибрюшино, в дозе 300 мг/кг. Затем животное фиксировали на операционном столике, состригали шерсть в области левого бедра и скальпелем разрезали кожу и мышечную ткань. Бедренную кость в области тазобедренного сустава обнажали, просверливали бедренную кость до костномозгового канала на 8-10 мм дистальнее сутава с помощью миниатюрной стоматологической бормашины (диаметр бора 0,8 мм). После повреждения кости производили послойное ушивание мягких тканей. Животных разделяли на две группы. Контрольную (15крыс) и опытную (15 крыс). У подопытных животных с помощью прибора «Остеон-1» проводили стимуляцию области травмы по 5 мин ежедневно в течение 7 сут. (оп7), 14 сут. (оп14) и 21 дня (оп21). Для этого животных фиксировали на операционных столиках и через введенные под кожу хирургические иглы подавали смешанный сигнал из двух импульсных напряжений разной скважности, один из которых модулирован более высокой частотой. Сигналы были не синхронизированными относительно друг друга, однополярными с изменяющимися частотами и амплитудами. Катод располагался в области травмы, анод помещался на ту же лапу дистальнее. Электростимуляцию осуществляли под общим наркозом (хлоралгидрат в дозе 190-200 мг/кг, внутрибрюшинно).
Три группы животных с нанесенной травмой служили контролем (к7, к14, к21), они также располагались на препаровальных столиках, им вводились хирургические иглы, но стимуляция не осуществлялась. В каждом варианте опыта использовали по 5 животных. На следующий день по окончании исследований животные выводились из эксперимента путем цервикальной дислокации. Затем извлекали бедренные кости всех 6-ти групп, которые использовали для гистологического анализа и оценки выраженности патологического процесса и процесса остеогенеза.
Кости животных фиксировали 24 часа при комнатной температуре в 10% формалине, приготовленном на фосфатно-солевом буфере (ФСБ, 0,02М, рН7.6). Декальцинировали в 5% трихлоруксусной кислоте 48 часов, затем промывали в ФСБ и замораживали в изопентане при -400С. Далее приготавливали срезы толщиной 5 мкм. Срезы высушивали при комнатной температуре в течение 1 часа и окрашивали гематоксилин-эозином. Для гистологического анализа от каждого животного было изготовлено от 100 до 200 серийных срезов бедренной кости, сделанных в поперечном и продольном направлениях. С помощью микроскопа Олимпус (ок. 10х, об. 4х). делали микрофотографии срезов костной ткани. Морфометрический анализ костной ткани внутри раневого канала (интермедиарная костная мозоль) осуществляли с помощью программы ImageJ [19]. Площадь костной ткани, измеренной на 3-5 срезах от каждого животного, выражали в % от площади канала. Для определения достоверности различий между опытом и контролем использовали непараметрический двусторонний критерий Манна-Уитни (U-тест).