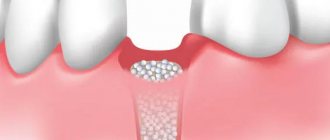
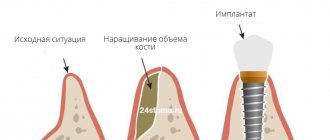
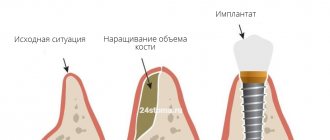
Остеопластика в стоматологии – наращивание костной ткани, необходимой для удачной имплантации. После того, как человеку удалили зуб, твердая ткань имеет свойство рассасываться, а новый искусственный зуб должен надежно держаться в челюсти. Наращивание кости для имплантации зубов успешно решает эту проблему, но требует дополнительных затрат и больше времени (чем, например, при одномоментной имплантации, когда объема ткани достаточно).
Вебинары по использованию EthOss от мировых клиницистов
РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
Костная пластика — одна из самых востребованных операций в челюстно-лицевой хирургии и стоматологии. Она нужна для подготовки пациента к установке дентального имплантата. Вследствие различных стоматологических патологий или длительного отсутствия зубов, кости подвергаются атрофическим процессам и становятся тонкими. Поскольку для установки и хорошей приживаемости имплантата кость должна быть достаточно плотной, костная пластика поможет исправить дефицит костной ткани.
Биологические костные материалы как правило создаются двумя способами — либо из костной ткани крупного рогатого скота, либо из трупных биоматериалов, тоесть из кости умерших людей. Да, это разрешено в большинстве стран, но согласитесь, в 21 веке использовать такую методику уже кажется не совсем современным способом восстановить улыбку, к тому же существует большой риск получить аллергическую реакцию, или личную непереносимость пациентом данных материалов, а также возникновение перекрестного заражения кости.
Поэтому технологии давно не стоят на месте, и британские клиницисты нашли выход из данной ситуации, и создали полностью безопасный синтетический костный материал, вызывающий естественную регенерацию кости человека, состоящий из бета-трифосфата кальция и сульфата кальция. Называется данная разработка — костный материал EthOss (Этос)
EthOss — это костный материал, разработанный имплантологами для имплантологов. Он состоит из абсолютно биосовместимых материалов, которые стимулируют процессы регенерации кости. Не содержит животных или человеческих компонентов.
Использование данного материала позволило достигнуть клинического успеха у огромного количества специалистов, так как EthOss устраняет необходимость в донорских трансплантатах и искусственных каркасах. Встроенный барьер устраняет необходимость в дополнительных мембранах и ускоряет хирургический процесс. Результатом этого становится более быстрая операция с минимально низким порогом боли для пациента.
Остеопластика – что это такое, и зачем она нужна?
При внедрении титанового корня очень важно, чтобы он со всех сторон был окружен костью. Если есть дефицит ткани, то титановый штифт будет отторгаться. Более того, если корень установлен в верхнюю челюсть, есть риск задевания верхнечелюстных пазух, что может привести к серьезным ЛОР-заболеваниям. Также при недостатке кости имплантат будет расшатываться, опустится ниже десны, что скажется на эстетике протеза и общей картине.
Остеопластика рекомендована в таких случаях:
- если необходимо установить корень в зону, где свой зуб был удален несколько лет (или месяцев) тому назад;
- если у пациента анатомически большие гайморовые пазухи;
- когда физиологически у человека минимальный объем твердой ткани.
Операция не выполняется, если:
- у пациента хронические ЛОР-заболевания (гаймориты, синуситы, риниты);
- нехватка кальция в организме;
- есть патологии в строении дыхательной системы;
- онкология;
- полипы и другие образования в носу;
- сахарный диабет.
Также остеопластика не выполняется беременным и кормящим женщинам. В остальном, операция делается относительно быстро и с гарантией.
Во многих случаях пациентам перед операцией рекомендуют пропить курс гормональных препаратов и антибиотиков, чтобы нейтрализовать отечные состояния и возможные воспаления.
Кто придумал костный материал EthOss?
Данный состав костного материала придумали два клинициста — доктор Питер Фейрберн и доктор Пол Харрисон.
Доктор Питер Фейрберн, профессор Школы стоматологии Детройтского университета (Мичиган, США), директор по образованию Ассоциации стоматологической имплантологии (Великобритания), один из президентов Лондонской стоматологической ассоциации, и доктор Пол Харрисон( член организаций PHD, MBA, BSC). Также он является мировым специалистом по дизайну стоматологических изделий.
После карьеры в академической сфере в Университете Лидса, др. Пол Харрисон основал независимую консалтинговую фирму по изобретению передовых материалов. Один успешный проект включал разработку метода растяжения кости с использованием внешних фиксаторов для укрепления сращения после перелома. Благодаря этому Пол увлекся вопросом костной регенерации.
С самого начала EthOss разрабатывался с учетом потребностей стоматологов. Настоящая костная регенерация это нечто большее чем использование костных материалов для создания обьема и искусственного каркаса. Доказано, что использование EthOss способствует более быстрому росту нативной кости при незначительных болевых ощущениях. С 2015 года его популярность среди стоматологов и пациентов растет очень быстро, чему так же способствовала британская Онлайн-Академия. Материал EthOss придуман и разработан клиницистами в Великобритании и доступен по всему миру.
Плюсы и минусы костной пластики при имплантации
Конкурентные преимущества костной пластики:
- восстановление функций, даже если у пациента утрачен большое количество твердой ткани;
- нормализуется внешний вид десневой ткани и ротовой полости в целом;
- восстановление жевательных функций – все виды костной ткани в стоматологии адаптированы под большие нагрузки;
- возможность восстановить зубной ряд, даже в самых запущенных ситуациях.
Недостатки костной пластики:
- реабилитация занимает несколько месяцев;
- высок риск отторжения блока;
- болевые ощущения в процессе приживления тканей;
- немалая цена операции.
Мнение специалиста
Игорь Юрьевич Малиновский
Челюстно-лицевой хирург, имплантолог
Стаж: более 11 лет
Остеопластическая операция нередко предшествует имплантации зубов. Особенно в тех, случаях, когда зуб был удален более года назад. Без нагрузки кость проседает, атрофируется, ее объема становится недостаточно для установки импланта. Именно поэтому так важно заниматься восстановление зубов сразу после их удаления. При большом количестве отсутствующих зубов единственным способом обойтись без остеопластики может быть базальная имплантация с более глубокой установкой имплантов в твердые слои костной ткани.
Расщепление альвеолярного отростка –
Используется при горизонтальной резорбции кости для увеличения толщины альвеолярного отростка. Может проводить как на нижней, так и на верхней челюсти. Нужно сказать, что это самый эффективный метод расширения альвеолярного отростка на сегодняшний день, который к тому же имеет малую себестоимость (он не требует дорогих костных материалов и мембран). Существует несколько разновидностей такого расщепления, но особо мы остановимся на методике «Split-Control», которая позволяет одновременно провести и расширение, и установку имплантов.
Содержание методики «Split-Control» (рис.5-10) – после отслойки слизисто-надкостничных лоскутов (десны) по центру гребня альвеолярного отростка делается пропил фрезой или же другими специальными инструментами на высоту будущего импланта (рис.6). Далее пилотным сверлом намечается отверстие под имплант(ы) и в подготовленные отверстия вкручиваются спредеры (рис.7). Использованием разных размеров спредеров от меньшего к большему – можно увеличить ширину гребня и сразу установить имплант.
По бокам импланта всегда остается щель, которая заполняется костным материалом, который при необходимости можно нанести с избытком и снаружи альвеолярного отростка, прикрыв это все специальной резорбируемой мембраной (рис.9). После чего рана ушивается, и мы ждем остеоинтеграции импланта в течение 3-4 месяцев.
Костная пластика нижней челюсти (метод расщепления) –
Плюсы методики –
- Во-первых – благодаря расщеплению гребня мы получаем костный дефект, который имеет костные стенки со всех сторон (кроме как сверху). Благодаря этому происходит быстрый и качественный остеогенез (образование новой кости), ведь губчатая кость в глубине альвеолярного отростка богата кровеносными сосудами, остеобластами, мезенхимальными клетками, факторами роста…
К слову о том, почему гораздо хуже увеличивать ширину кости не за счет расщепления (изнутри альвеолярного отростка), а делать это за счет внешнего прикрепления костных блоков или костной стружки снаружи кортикальной пластики альвеолярного отростка (24stoma.ru). Дело в том, что внешний кортикальный слой кости очень плотный и в нем практически отсутствуют сосуды. Соответственно, подсаживаемый костный материал будет очень долго прорастать сосудами, медленнее будет идти образование кости, будет больше риск неудачи и осложнений такой костной пластики.
- Во-вторых – тут не нужно дорогих костных материалов и мембраны, опять же за счет того, что это трехстеночный дефект внутри альвеолярного отростка, а не снаружи его. Тут достаточно недорогих материалов, например, костного материала «Остеодент-К» и мембраны «Остеодент-Барьер». Но если вы принципиальны, то можно использовать и дорогие материалы типа «Bio-Oss».
- В-третьих – установка имплантов при этой методике в большинстве случаев возможна сразу. Если импланты будут устанавливаться позже, то между операциями должно будет пройти всего 3-4 месяца, что значительно меньше, по сравнению с другими методиками костной пластики.
Расщепление альвеолярного отростка: анимация и видео операции
Важно: существуют несколько разновидностей методики расщепления. При «Split-Control» фрезой делаются только пропил по гребню альвеолярного отростка + пара вертикальных пропилов на толщину кортикальной пластинки. Но существует разновидность этого метода, где делается еще и дополнительный горизонтальный пропил на уровне верхушек будущих имплантов, что приводит к полному отсоединению костного блока (вестибулярной кортикальной пластинки).
Потом этот блок фиксируют винтами, которые его часто и ломают. Импланты при такой модификации методики устанавливают не сразу, а спустя 3-4 месяца. Кроме того, это весьма травматично и больше риск осложнений. Эта разновидность методики должна применяться только при самом тонком альвеолярном отростке (2 мм), но некоторые врачи используют ее даже в тех случаях, когда этого делать не нужно.
Характеристики
В ходе производства Био-Осс из сырья извлекаются органические компоненты. Используется только фосфат кальция, представляющий собой минеральную основу, в которой есть много микрокапилляров и микротоннелей.
По физико-химическим характеристикам Bio Oss схож с костной тканью человека. Отсюда положительная реакция человеческого организма на данный материал, который хорошо интегрируется с первичной костью пациента.
Наружная топография имплантируемых материалов имеет шероховатую поверхность, способствующую адгезии имплантируемого материала, разрастанию молодых клеток и скорому синтезу соединительной ткани.
Большая площадь внутренних поверхностей имплантата способствует интенсивному врастанию в него кровеносных сосудов, а также активной и скорой интеграции, заживлению открытых ран.
Примеры работ «До» и «После»
Восстановление жевательных зубов нижней челюсти
Случай: разрушение жевательной группы зубов нижней челюсти справа под мостовидным протезом.
Базальная имплантология с моментальной нагрузкой
Случай: Пациент жаловался на неудобный съемный протез.
Восстановление всех зубов на верхней и нижней челюсти — базальная имплантация
Случай: частичное отсутствие зубов на верхней и нижней челюсти, осложненное тяжелой формой пародонтита (подвижность зубов).
Одномоментная имплантация в боковых отделах верхней и нижней челюсти
Случай: разрушение зубов под коронками в боковых отделах верхней и нижней челюстей.
Экстраназальным операциям отводится значительная роль в хирургии околоносовых пазух [1, 2]. Однако после экстраназальных операций на околоносовых пазухах остаются значительные костные дефекты, в которые происходит врастание мягких тканей. Результатом являются застой секрета в пазухе, пролиферация фиброзной ткани и развитие рубцевания, которое, в конечном итоге, ведет к уменьшению объема пазухи и утолщению костных стенок пазухи [3, 4]. Склонность к облитерации наиболее отчетливо проявляется после операции по Колдуэллу—Люку в детском возрасте [5]. Кроме того, появляется западение мягких тканей лица в области дефекта [6], возникают боли невралгического характера вследствие сдавления ветвей тройничного нерва рубцовой тканью [7].
В настоящее время большинство клиницистов придерживаются мнения о необходимости закрытия послеоперационных дефектов в стенках околоносовых пазух. Однако, несмотря на достигнутые успехи в применении дренирующих операций, в практике оториноларинголога наблюдаются такие патологические состояния лобно-решетчатой зоны, когда сохранение лобной пазухи как воздухоносной полости не представляется возможным, и возникает необходимость облитерации пораженных лобных пазух [8—13].
С целью облитерации используются как ауто- и аллотрансплантаты, так и клеевые остеопластические композиции [14—19]. Во время операции на лобной пазухе для ее облитерации из пазухи тщательно удаляют все содержимое и всю слизистую оболочку. Достигается полная изоляция пазухи и трансплантата от внешней среды, восстанавливаются контуры лобной области [20]. У данной методики есть свои минусы. В литературе [19] описаны случаи расплавления аллотрансплантата с образованием полости и гнойного свища лобной пазухи, случаи формирования вторичного пиомукоцеле и ограниченного остеомиелита передней стенки лобной пазухи [19].
В поисках другого способа закрытия дефектов стенок пазух наиболее рациональным решением проблемы является пластическое восстановление стенок околоносовых пазух различными материалами. Сегодня на мировом рынке существует огромное количество каркасных материалов. Костные трансплантаты — это любые имплантируемые материалы, которые сами по себе или в комбинации с другими материалами способствуют формированию кости, обеспечивая локальную остеокондуктивную, остеоиндуктивную или остеогенную активность.
Остеокондуктивные материалы способствуют прикреплению, пролиферации и дифференцировке малодифференцированных клеток в остеобласты с последующим формированием кости на их поверхности. Остеокондуктивным остеогенезом считается «ползучее замещение», т. е. первичное рассасывание импланта с вторичным последующим врастанием опорных тканей из материнского ложа. В этих случаях имплант играет роль каркаса для прорастания кровеносных сосудов. Затем происходит врастание клеток из материнского ложа. Этот механизм сочетает в себе процессы резорбции и формирования новой опорной ткани, начиная от границ дефекта. Остеоиндуктивные материалы содержат биологически активные вещества, индуцирующие клетки ложа реципиента к дифференцировке в остеобласты [21]. Остеогенные материалы (аутотрансплантаты и материалы, обогащенные культивируемыми аутогенными костными клетками) содержат живые клетки «хозяина», способные дифференцироваться в остеобласты.
Любые костные трансплантаты должны обладать следующими свойствами: а) быть полностью биосовместимыми и биоинертными; б) быть пористыми; в) служить матрицей, на поверхности которой фиксируются клетки реципиента (остеокондуктивность); г) постепенно резорбироваться и замещаться новообразованной костью (ползущее замещение); д) иметь плотность и физические свойства, близкие к ткани, куда он помещается, а также способность сопротивляться механическим нагрузкам; е) быть легко доступным, хорошо сохраняться и стерилизоваться; ж) при подготовке к трансплантации легко обрабатываться для получения нужной формы; з) не отторгаться [22].
В настоящее время для пластики используют как синтетические, так и природные материалы. Основные типы костных имплантов:
1. Аутотрансплантат — донором является сам пациент.
Это могут быть костные лоскуты, измельченная или консервированная аутокость или хрящ. Поскольку вживляется собственная костная или хрящевая ткань, обеспечивается очень хорошая совместимость с участком, в который имплантируется ткань, а также со всеми остальными прилегающими тканями. Сущность остеопластических методов, применяемых в ринологии, заключается в создании различных модификаций костно-надкостничного пластического лоскута, который «выламывается» из стенки лобной или верхнечелюстной пазухи перед операцией и укладывается на прежнее место в конце операции [23—25]. Также для закрытия дефектов передней стенки лобной пазухи [26] и верхней стенки верхнечелюстной пазухи применяются аутохрящи перегородки носа [27]. У данного метода есть и недостатки. Забор аутокости или хряща может сопровождаться осложнениями: повреждением сосудов и нервов, образованием гематом, развитием инфекционно-воспалительного процесса. Кроме того, аутотрансплантаты часто резорбируются быстрее, чем происходят их интеграция и восстановление костного дефекта [28].
2. Аллотрансплантат — донором является другой человек.
Речь идет о костном трансплантате, взятом у донора. К аллотрансплантатам относятся эмбриональная закладка или кость, свежая аллогенная кость, измельченная аллогенная кость, консервированная кость и деминерализованный костный матрикс. Организм реципиента способен трансформировать костную ткань подобного типа в собственную ткань, и поэтому после имплантации чужеродная костная ткань приживается в организме, превращаясь в собственную. Костные аллотрансплантаты отличаются медленной остеоинтеграцией, при их использовании имеется риск развития реакции гистонесовместимости и хронического гранулематозного воспаления [29].
Из биологических материалов в последние десятилетия для закрытия различных дефектов костных структур в оториноларингологии широкое распространение получили деминерализованные костные трансплантаты, именуемые некоторыми авторами «костный матрикс». Проф. А.Г. Волков одним из первых в специальности использовал деминерализованный костный трансплантат — ДТК, который представляет собой определенным образом обработанную трупную кость, для восстановления обширных дефектов кости, возникающих после радикального хирургического лечения при опухолях лобных пазух. Деминерализованный костный матрикс использовали при пластике наружного носа, носовой перегородки [22, 30], для восстановления разрушенной при переломе нижней стенки орбиты [31], переломах стенок лобных пазух [32]. Подобный костно-пластический материал с коммерческим названием «Перфоост» представляет собой деминерализованные лиофилизированные перфорированные пластины, приготовленные из длинных и плоских костей аллогенного происхождения. Аллоимплант «Перфоост» с успехом применяется при реконструктивно-пластических операциях на перегородке носа, требуемых возмещения дефекта как хрящевого, так и костного отдела перегородки носа [21].
Ряд авторов [22] обратили внимание на возможность использования кости плода (брефоматрикс). Благодаря своим выраженным остеоиндуктивным свойствам эмбриональный матрикс с успехом применяется у больных с различными дефектами наружного носа и носовой перегородки.
3. Ксенотрансплантат — источник животного происхождения. Это костный или хрящевой трансплантат, взятый из тела животного. Когда трансплантат находится в организме, происходит процесс его замещения человеческой тканью, при этом он является «каркасом» для формирования собственной костной ткани человека. Недостатком ксенотрансплантатов является то, что они рассасываются и замещаются новой костной тканью крайне медленно. В ринологии консервированные реберные хрящи свиньи применялись при ринопластиках, для облитерации лобных пазух и пластики лобно-орбитальной области после экстраназального удаления остеомы решетчатого лабиринта [33].
4. Синтетический источник.
Этот имплант представляет собой инертное, синтетическое, искусственное вещество, которое производится в лабораториях. Применение искусственных материалов позволяет избежать предварительной имплантации поблизости от дефекта и не ограничивает хирурга в количестве материала.
По данным литературы, к синтетическим имплантируемым материалам относятся эксплантаты (металлы, полимеры, пористоуглеродные соединения, керамика). В зависимости от способа изготовления и типа материала, заменители кости подразделяются на «абсорбируемые», или биодеградируемые, и «не абсорбируемые». Иными словами, наш организм может заменить либо не заменить синтетический материал собственной костной тканью в зависимости от типа материала. Если эти импланты имеют поры с диаметром более 100 мкм, может происходить врастание кости, что обеспечивает ее крепление к материалу (биологическая фиксация).
Основным недостатком синтетических материалов, в отличие от ауто-, алло- и некоторых ксеноматериалов, является отсутствие у них свойств остеоиндукции. К остеоиндукции костезамещающих материалов следует относить их способность стимулировать регенерацию костной ткани. С этой целью были созданы композитные материалы. Композитные материалы — это комбинация остеокондуктивного матрикса с биоактивными агентами, обеспечивающими остеоиндуктивные и/или остеогенные свойства, что уравнивает эти материалы по биоактивным свойствам с ауто-, алло-, и ксенотрансплантатами. Такая биологическая активность может быть обусловлена включением в состав костезамещающего материала сульфатированных гликозаминогликанов, аминокислот, факторов роста и морфогенов [34].
Ряд кальций-фосфатных материалов, таких как гидроксиапатит, трикальцийфосфат, некоторые составы силикатного стекла и стеклокерамики, относятся к биоактивным материалам, близким по своему составу к костной ткани человека. Последние способствуют образованию на их поверхности кости и формированию с последней прочных химических связей (биоактивная фиксация). Эти биоактивные материалы являются остеокондуктивной матрицей, вызывающей адгезию морфогенетических белков, клеток предшественников остеобластов, их пролиферацию и дифференцировку в остеобласты. Синтетические материалы на основе искусственного гидроксиапатита по ряду характеристик превосходят гидроксиапатит животного происхождения. Они исключают возможность переноса инфекционных заболеваний, позволяют регулировать скорость резорбции за счет особенностей синтеза, различных замещений фосфатных и гидроксильных групп в структуре апатита. Это характеризует синтетический гидроксиапатит как перспективный остеопластический материал для использования во всех областях костно-пластической хирургии.
В исследуемой литературе [25] есть работы по применению гидроксиапатита для закрытия дефекта в верхней стенке верхнечелюстной пазухи [35], послеоперационных дефектов стенок околоносовых пазух после удаления остеом. Одним из недостатков кальций-фосфатной керамики является незначительная механическая прочность данного вида имплантов.
Пригодной для целей пластики стенок околоносовых пазух по физико-химическим свойствам оказалась корундовая керамика, которая обладает биоинертностью и биосовместимостью, высокой степенью прочности [36]. Но, к сожалению, полноценное моделирование пластинок из корундовой керамики по форме сложного дефекта в стенках лобных пазух невозможно [37].
Очень широко используются для пластики послеоперационных и посттравматических костных дефектов околоносовых пазух и черепа сетчатые титановые импланты [38—41]. В исследуемой литературе встретилась работа, где пористый никелид титан использовался для закрытия перфораций перегородки носа и постэкстрационных свищей [42]. Имплантируемые в организм конструкции из этих сплавов деформируются в соответствии с закономерностями эластического поведения тканей организма, обеспечивают длительное гармоничное функционирование. Кроме того, пористый никелид титана, имеющий физико-механические свойства, близкие к параметрам костной ткани (размеры пор, проницаемость, общие закономерности эластического поведения), обеспечивает благоприятные условия для врастания в поры тканевых структур и сращения его с костью реципиента [43, 44]. Однако даже титановые импланты могут провоцировать реакции отторжения. Поэтому с целью изоляции титана от прилегающих живых тканей организма на титановую сетку наносится покрытие из биоситалла — биоактивного материала для улучшения оссеоинтеграции и биосовместимости [16, 45, 46].
Большой клинический интерес представляют данные о реакции тканей и течение раневого процесса при имплантации полимерных материалов [47, 48]. Так, с целью пластики костного дефекта при остеомах околоносовых пазух с успехом использовались полифосфазеновые эндопротезы [49], протакрил [26], для закрытия посттравматического дефекта верхней стенки верхнечелюстной пазухи — силикон [50] или тефлон [51]. Пластический материал из полиэфира — «Трикотажный материал для восстановления костных и хрящевых структур» использовался для коррекции контуров носовой перегородки, стенок околоносовых пазух [52].
В настоящее время наибольший клинический интерес вызывают комбинированные синтетические материалы. Комбинированные формы состоят из полимерной матрицы и нано-гидроксиапатита как наполнителя. Появление композитов из синтетического гидроксиапатита в форме порошков, гранул и гелей в сочетании с полисахаридами, хитозаном, альгинатом, гиалуроновой кислотой, белком коллагеном, пептидами, лекарственными и другими препаратами расширило возможности восстановления костных тканей [53—55].
В связи с этим актуальны разработка и внедрение в клинику новых материалов для пластики костных стенок.
Аутогенные остеопластические материалы в стоматологии
По данным литературы, чаще всего в хирургической стоматологии используется аутопластический метод — пересадка кости, полученной из другой части тела самого пациента. Впервые аутогенный трансплантат испытан хирургом Уолтером в 1820.
На протяжении последующих двух веков материал, полученный от пациента, традиционно считался «золотым стандартом
» остеопластики. Не в последнюю очередь это было обусловлено несовершенством технологий обработки чужеродных остеопластических материалов и низким развитием химического производства, ограничивающим доступ к более совершенным опциям.
Сторонники аутогенных графтов указывают на высокую остеогенность (за счет наличия клеток), остеокондукцию (благодаря содержанию минералов и коллагена) и остеоиндуктивные свойства (за счет неколлагеновых белков костного матрикса).
По своей структуре аутотрансплантаты могут быть кортикальными, губчатыми и губчато-кортикальными. Принято считать, что при использовании губчатых костных материалов происходит более быстрая и полноценная реваскуляризация трансплантата.
Это возможно благодаря содержанию плюрипотентных клеток
, которые способны дифференцироваться и пролиферировать, участвуя в остеогенезе. В кортикальных графтах указанные процессы протекают медленно.
Ряд исследователей считают, что губчато-кортикальные фрагменты за счет прочной кортикальной части обладают достаточными механическими свойствами, а губчатая составляющая способствует повышению остеогенного потенциала.
Чаще всего внеротовыми участками для забора остеопластического материала служит нижняя челюсть, реже — тазовая кость, латеральный край лопатки или ребро. По мнению зарубежных специалистов, ткань из тазовой кости и челюсти отличается высоким регенеративным потенциалом и меньше поддается резобрции.
В любом случае, только для получения аутогенного остеопластического материала необходимо выполнять дополнительное вмешательство. Это означает привлечение анестезиологов и хирургов, дополнительные риски и затраты.
Если для выполнения остеопластики требуется получить внутриротовой трансплантат, оптимальным донорским участком является тело либо ветвь нижней челюсти, ретромолярная область, подбородочный симфиз и горб верхней челюсти.
Забор биоматериала производится под местной анестезией, что упрощает весь лечебный процесс, однако дополнительная травматизация и риски остаются.
Стоит упомянуть, что одной из основных причин отказа от данного вида остеопластики является страх пациентов перед хирургическим вмешательством и естественное желание закончить лечение с минимальной кровью (в буквальном смысле).
Несмотря на очевидные преимущества аутотрансплантатов (биосовместимость, инфекционную безопасность, регенеративный потенциал), они имеют существенный недостаток. Проблема заключается в резорбции трансплантата в динамике, преимущественно при использовании внеротовых графтов
.
Нужно помнить о возрастных аспектах, переносимости дополнительного хирургического вмешательства у отдельных категорий пациентов.
Метод с осторожностью используется в пожилом и детском возрасте, в том числе из-за недостаточного количества кости и риска повреждения ростовых зон у детей.
Необходимость забора кости всегда сопряжена с дополнительным риском инфицирования донорского участка, кровопотерей, увеличением продолжительности послеоперационного периода, повышенной потребностью в обезболивающих препаратах, ростом медицинских расходов и др.
Потребность в преодолении этих недостатков аутотрансплантации обусловили быстрое развитие альтернативного метода — аллотрансплантации. Впервые в мире новаторский метод замещения костных дефектов, при котором донором выступает другой человек, использовали в 1880 году под руководством Уильяма Макьюэна.
Вместо эпилога. Какие биоматериалы самые лучшие?
Geistlich Biomaterials, однозначно)))). Ибо RegenerationDay.
Ответ на этот вопрос и, может быть, совсем не от меня, а от Владимира Владимировича Путина более авторитетного человека хотели бы услышать не только пациенты, но и доктора-остеорегенераторы. Ибо на всех медицинских форумах, во всех профессиональных сообществах, на всех дискуссионных площадках ведутся бесконечные споры о том, что лучше и почему.
На мой взгляд, чтобы ответить на этот вопрос, его нужно, как минимум, переформулировать. Как-то так:
Преимущества деминерализованной лиофилизированной кости с доказанной остеоиндуктивной активностью
Среди всех представленных на рынке материалов можно выделить продукт под названием АллоГро от крупнейшего банка тканей в США. Этот препарат является деминерализованным имплантатом лиофилизированной кости, остеоиндуктивная активность которого определяется посредством проб. Необходимость проведения этой пробы заключается в том, что индуктивные свойства донорской ткани сильно выражены, а проведение биопробы отсеивает около 10% доноров для производства материала для имплантации. Сегодня с целью экономии средств для теста на остеоиндуктивную активность в лабораториях используют культуры клеток типа SAOS-2 (остеогенная человеческая саркома), в которую помещают тимидин и КМП донора. В результате определяется активность клеточного деления и скорость выведения тимидина. Эти данные позволяют рассчитать остеоиндуктивную эффективность.
В результате этих клинических исследований, компания смогла присвоить продукту ярлык «Доказанная остеогенная активность». Одним из рисков при применении аллогенных трансплантатов является передача вирусной инфекции, такой как гепатит или СПИД. Но на сегодняшний момент не запечатлены случаи инфицирования каким-либо вирусом, даже теми инфекциями, зоной для развития которых является твердая мозговая оболочка. Сегодня ДЛК является самым экономичным и эффективным остеогенным материалом.
Виды, источники происхождения и состав
В общих чертах, все существующие барьерные мембраны можно разделить на две группы: резорбируемые и нерезорбируемые. Также существуют мембраны с очень длительным периодом резорбции и их, вроде как, пытаются выделить в отдельный класс, но на мой взгляд, их следует отнести к резорбируемым, ибо в конце концов они всё равно рассасываются и исчезают. Нерезорбируемые мембраны изготавливаются из разных биоинертных материалов (тефлон, ПТФЭ, титановые сплавы и т. д.), используются они значительно реже, про них мы поговорим, когда будем рассматривать остеопластику методом НКР.
Здесь и далее, мы будем говорить о наиболее распространенных в хирургической практике резорбируемых барьерных мембранах.
Основной компонент существующих на рынке барьерных мембран – это коллаген, органическое вещество белковой природы, главный структурный элемент соединительной ткани. Источником коллагена для барьерных мембран на 98% являются лучшие друзья и, заодно, еда человека – свинки. Изредка используется аллоколлаген (человеческого происхождения) или что-то другое (биополимеры, производные полисахаридов и т. д.).
Главная причина использования коллагена для производства барьерных мембран – это его предсказуемый распад естественным путём с помощью ферментов-коллагеназ и образованием, обычных для организма аминокислот. Без лишних продуктов распада и прочих ЛСД.
Ну, да ладно. Нас, конечных потребителей барьерных мембран, волнуют не столько секреты производства, сколько ряд критериев, важных для практики. Они, в целом, похожи на то, что мы ждём от остеографтов и биоматериалов вообще, и включают в себя:
Форм фактор.
размеры, упаковка, и т. д. Одна и та же барьерная мембрана может быть разной площади. Так, используемая нами Geistlich Bio-Gide выпускается в размерах 16х22, 25х25 и 30х40 мм
И мы выбираем нужный размер, в зависимости от масштабности хирургического вмешательства.
Физические и биологические свойства.
По аналогии с остеографтами, барьерные мембраны должны обладать рядом физических и биологических свойств.Конечно информация о свойствах важна, в первую очередь, для доктора, а не для пациента. Однако, представление о свойствах необходимо и вам, друзья, для понимания того, как мы, врачи, ориентируемся, выбирая барьерную мембрану для решения той или иной клинической задачи.
гидрофильность – ну, это само собой, ведь жидкость – это главная транспортная среда организма.
прочность – способность барьерной мембраны сохранять целостность при нагрузке и фиксации. Она не должна превращаться в лохмотья, если мы решили её забить пинами или прикрутить винтами, подлежащий графт не должен прорезываться, а натянутая мембрана – расползаться.
эластичность – барьерная мембрана должна принять форму того участка, к которому мы её адаптируем. Без лишних заломов и обработки напильником.
адгезия – идеальная барьерная мембрана, буквально, прилипает к подлежащему графту и, чаще всего, не требует какой-то специальной фиксации.
Про свойства барьерных мембран можно очень долго рассуждать. И мы однажды это сделаем, в ходе эксперимента под названием “М.П.”. Вам же, друзья, нужно про свойства два момента:
– физические свойства определяют то, как ведёт себя барьерная мембрана в ходе операции. Облегчает ли она работу доктора и удешевляет ли её, или наоборот, усложняет и требует применения чего-то дополнительного. Пинов и винтов, к примеру.
– биологические свойства определяют то, что происходит с барьерной мембраной после операции. Они трудноизмеримы и, практически, неизучимы объективно. Поэтому, апеллируя к биологическим свойствам, можно “впарить” вам всё, что угодно. Именно поэтому такие критерии как “проницаемость” и “время резорбции”, до сих пор являются предметов ожесточённых споров, дискуссий, драк и прочих зарубов в профессиональном стоматологическом сообществе. И, именно поэтому я призываю вас как можно меньше им верить.
А нам с вами осталось рассмотреть еще одну категорию биоматериалов:
Какие имплантаты используются после подсадки кости?
Есть ли «особенные имплантаты», которые рекомендуются в случаях проведения костной пластики? Как при подсадке кости, так и без подсадки кости надо использовать имплантаты только хороших, проверенных производителей, таких, которые имеют хорошую клиническую базу. Например – Straumann, Nobel, Ankylos, Xive, Astra Tech.
Есть еще ряд систем имплантов, которые дают хороший результат. Но в Немецком имплантологическом центре мы используем только лучшие системы имплантов, только премиум класса.
Наращивание костной ткани нижней челюсти
Операция также имеет свою специфику, так как в этой проекции располагается большое скопление нервов, нижнечелюстного канала, височно-нижнечелюстного сустава и т.п. Важно подсадить кость аккуратно, не задеть и не передавить окончания нервов.
Для нижней челюсти характерна подсадка донорского состава, который берется из области зубов мудрости или же подбородочной части. Донорский блок фиксируется с помощью металлических винтов, просветы заполняются костной стружкой. Через несколько месяцев, как только блок прижился, винты извлекаются, можно переходить к процедуре имплантации.
Самый распространенный вопрос: можно ли обойтись без восполнения объема кости? Да, в некоторых случаях можно. Например, при экспресс-имплантации, когда корневидный имплантат внедряется сразу же после удаления своего зуба. Практически во всех других случаях, даже если с момента удаления зуба прошел месяц, без наращивания костной ткани не обойтись. Но эта операция является гарантией стабильного положения имплантата – надежности, долговечности и идеального результата имплантации и протезирования.
Особенности применения материала
До введения материала в качестве имплантируемой ткани его смачивают стерильным физраствором, кровью пациента или его же плазмоцитарной массой. Время между смачиванием и введением на место костного дефекта составляет 5 минут. Место заполнения также подлежит подготовке: оно освобождается от грануляционных тканей.
После введения материала на место дефекта и конгруэнтного моделирования в ложе он покрывается периостальным лоскутом. Затем следует ушивание.
После проведения процедуры на этом месте может наблюдаться небольшой отек на протяжении двух-трех дней. Это нормальная реакция окружающих тканей на оперативное вмешательство. При необходимости возможно наблюдение лечащего врача в этот период.